 Helicobacter pylori (лат. спиралевидная бактерия, обитающая в привратнике желудка [1]. традиционная транскрипция — Х(Г)еликоба́ктер пило́ри [1] [2] ) — спиралевидная грамотрицательная бактерия. которая инфицирует различные области желудка и двенадцатиперстной кишки. Многие случаи язв желудка и двенадцатиперстной кишки. гастритов. дуоденитов. рака желудка и, возможно, некоторые случаи лимфом желудка этиологически связаны с инфекцией Helicobacter pylori. Однако у большинства (до 90 % [3] ) инфицированных носителей Helicobacter pylori не обнаруживается никаких симптомов заболеваний [4] .
Helicobacter pylori (лат. спиралевидная бактерия, обитающая в привратнике желудка [1]. традиционная транскрипция — Х(Г)еликоба́ктер пило́ри [1] [2] ) — спиралевидная грамотрицательная бактерия. которая инфицирует различные области желудка и двенадцатиперстной кишки. Многие случаи язв желудка и двенадцатиперстной кишки. гастритов. дуоденитов. рака желудка и, возможно, некоторые случаи лимфом желудка этиологически связаны с инфекцией Helicobacter pylori. Однако у большинства (до 90 % [3] ) инфицированных носителей Helicobacter pylori не обнаруживается никаких симптомов заболеваний [4] .
История открытия [ править | править код ]
В 1875 году немецкие учёные обнаружили спиралевидную бактерию в слизистой оболочке желудка человека. Бактерия не росла в культуре (на известных в то время искусственных питательных средах ), и это случайное открытие было забыто [6] .
В 1886 году профессор Валерий Яворский ( польск. ) из Ягеллонского университета в Кракове, исследуя осадок из промывных вод желудка человека, обнаружил помимо бактерий. напоминавших по форме хворостины, также некоторое количество бактерий характерной спиралеобразной формы. Он назвал обнаруженную им бактерию Vibrio rugula. Он был первым, кто предположил возможную этиологическую роль этого микроорганизма в патогенезе заболеваний желудка. Его работа на эту тему была включена в польское «Руководство по заболеваниям желудка» и опубликована в 1899 году. Однако эта работа не имела большого влияния на остальной врачебный и научный мир, поскольку была написана на польском языке [7] .
В 1893 году итальянский исследователь Джулио Бидзодзеро описал похожую спиралевидную бактерию, живущую в кислом содержимом желудка собак [8] .
В 1974 году профессор И. А. Морозов из Москвы обнаружил спиралевидные бактерии в материале больных после ваготомии во внутриклеточных канальцах клеток желудка, а также у больных язвой, которым не делали ваготомию. Однако способ выращивания этих бактерий не был известен микробиологам, и обнаруженные бактерии были забыты ещё на десять лет [9] [10] .
Бактерия была вновь открыта в 1979 году австралийским патологом Робином Уорреном. который затем провёл дальнейшие исследования её вместе с Барри Маршаллом. начиная с 1981 года. Уоррену и Маршаллу удалось выделить и изолировать этот микроорганизм из проб слизистой оболочки желудка человека. Они также были первыми, кому удалось культивировать этот микроорганизм на искусственных питательных средах [11]. В оригинальной публикации [12] Уоррен и Маршалл высказали предположение, что большинство язв желудка и гастритов у человека вызываются инфицированием микроорганизмом Helicobacter pylori. а не стрессом или острой пищей, как предполагалось ранее [13] .
Гистологический препарат слизистой желудка, демонстрирующий геликобактерный гастрит и колонизацию слизистой геликобактером. Окраска серебром по Warthin-Starry .
Медицинское и научное сообщество медленно и неохотно признавало патогенетическую роль этой бактерии в развитии язв желудка и двенадцатиперстной кишки и гастритов, вследствие распространённого в то время убеждения, что никакой микроорганизм не в состоянии выжить сколько-нибудь длительное время в кислом содержимом желудка. Признание научным сообществом этиологической роли этого микроба в развитии заболеваний желудка начало постепенно приходить лишь после того, как были проведены дополнительные исследования. Один из наиболее убедительных экспериментов в этой области был поставлен Барри Маршаллом: он сознательно выпил содержимое чашки Петри с культурой бактерии H. pylori. после чего у него развился гастрит [14]. Бактерия была обнаружена в слизистой его желудка, тем самым были выполнены три из четырёх постулатов Коха. Четвёртый постулат был выполнен, когда на второй эндоскопии, спустя 10 дней после преднамеренного заражения, были обнаружены признаки гастрита и присутствие H. pylori. Затем Маршалл сумел продемонстрировать, что он в состоянии излечить свой геликобактерный гастрит с помощью 14-дневного курса лечения солями висмута и метронидазолом [14]. Маршалл и Уоррен затем пошли дальше и сумели показать, что антибиотики эффективны в лечении многих, если не большинства, случаев гастрита и язв желудка и двенадцатиперстной кишки [14] .
В 1994 году Национальный институт здравоохранения США опубликовал экспертное мнение, в котором утверждалось, что большинство рецидивирующих язв желудка и гастритов с повышенной кислотностью вызываются инфицированием микробом H. pylori. и рекомендовал включать антибиотики в терапевтические режимы при лечении язвенной болезни желудка, а также гастритов с повышенной кислотностью [15]. Постепенно накапливались данные также о том, что язвы двенадцатиперстной кишки и дуодениты также ассоциированы с инфицированием H. pylori [16] [17] .
До того как стала понятна роль инфекции H. pylori в развитии язвенной болезни желудка и двенадцатиперстной кишки и гастритов, язвы и гастриты обычно лечили лекарствами. которые нейтрализуют кислоту (антациды ) или снижают её продукцию в желудке (ингибиторы протонного насоса. блокаторы H2-гистаминовых рецепторов. М-холинолитики и др.). Хотя такое лечение в ряде случаев бывало эффективным, язвы и гастриты весьма часто рецидивировали после прекращения лечения. Весьма часто используемым препаратом для лечения гастритов и язвенной болезни желудка и двенадцатиперстной кишки был субсалицилат висмута (пепто-бисмол). Он часто был эффективен, но вышел из употребления, поскольку его механизм действия оставался непонятным. Теперь стало ясно, что эффект пепто-бисмола был обусловлен тем, что соли висмута действуют на H. pylori как антибиотик. Сегодня большинство случаев язв желудка и двенадцатиперстной кишки, некоторых форм гастритов с доказанной лабораторными тестами геликобактерной этиологией, особенно в развитых странах, лечат антибиотиками в совокупности с ингибиторами протонной помпы, эффективными против H. pylori [19] [20]. По последним уточненным данным на долю язвенной болезни, связанной с инфекцией H. pylori. приходится 38 % язв желудка и 56 % язв двенадцатиперстной кишки во всем мире [21] .
Хотя H. pylori остаётся наиболее медицински значимой бактерией, способной обитать в желудке человека. у других млекопитающих и некоторых птиц были найдены другие представители рода Helicobacter. Некоторые из них могут заражать и человека. Виды рода Helicobacter были также обнаружены в печени некоторых млекопитающих, причём они способны вызывать поражения и заболевания печени [22] .
Систематика [ править | править код ]
Бактерия была вначале названа Campylobacter pyloridis в 1985 году. затем название было исправлено в соответствии с правилами латинской грамматики на Campylobacter pylori в 1987 году [23]. и только в 1989 году. после того, как анализ последовательностей ДНК этой бактерии показал, что в действительности она не принадлежит к роду Campylobacter ( англ. ). её и близкие ей виды выделили в отдельный род, Helicobacter Goodwin et al. 1989 [24]. Слово pylōri в названии является формой родительного падежа от «pylōrus» (привратник желудка, циркулярный жом, перекрывающий проход из желудка в двенадцатиперстную кишку), которое, в свою очередь, происходит от др.-греч. πυλωρός. означающего буквально «привратник».
Многие виды рода Helicobacter являются патогенными для человека и животных и обитают в ротовой полости, желудке, различных отделах кишечника человека и животных (патогенными для человека и животных кроме H. pylori являются также виды H. nemestrinae. H. acinonychis. H. felis. H. bizzozeronii и H. salomonis )) [25]. Наибольший уровень сходства по результатам ДНК-ДНК гибридизации отмечен между видами H. pylori и H. mustelae [25] .
Виды рода Helicobacter являются единственными известными на сегодняшний день микроорганизмами. способными длительно выживать в чрезвычайно кислом содержимом желудка и даже колонизировать его слизистую [26] .
Разработано много методов определения как внутривидовой дифференциации штаммов H. pylori. так и для дифференцировки от других видов рода Helicobacter. такие как биотипические. и серологические методы. методы определения уреазной активности и токсинообразования, так и молекулярные — белковый электрофорез клеточного лизата, метод определения полиморфизма длин рестрикционных фрагментов (ПДРФ), полимеразная цепная реакция (ПЦР), секвенирование 16S рибосомальной РНК [25]. Показан высокий уровень внутривидового полиморфизма штаммов H. pylori по сравнению с крайне близким видом H. mustelae. проявляющим высокий уровень консерватизма. Полиморфизм заключается в однонуклеотидных заменах. а также крупных внутригеномных перестройках, и высоких частотах трансформации [25] .
Строение [ править | править код ]
Размеры и схематическое строение H. pylori
Helicobacter pylori — спиралевидная грамотрицательная бактерия. около 3 мкм в длину, диаметром около 0,5 мкм. Она обладает 4–6 жгутиками и способностью чрезвычайно быстро двигаться даже в густой слизи или агаре. Она микроаэрофильна. то есть требует для своего развития наличия кислорода. но в значительно меньших концентрациях, чем содержащиеся в атмосфере .
Бактерия содержит гидрогеназу, которая может использоваться для получения энергии путём окисления молекулярного водорода. продуцируемого другими кишечными бактериями [27]. Бактерия также вырабатывает оксидазу, каталазу и уреазу .
Helicobacter pylori обладает способностью формировать биоплёнки. способствующие невосприимчивости бактерии к антибиотикотерапии и защищающие клетки бактерий от иммунного ответа хозяина [28]. Предполагают, что это увеличивает её выживаемость в кислой и агрессивной среде желудка.
В неблагоприятных условиях, а также в «зрелых» или старых культурах Helicobacter pylori обладает способностью превращаться из спиралевидной в круглую или шарообразную кокковидную форму. Это благоприятствует её выживанию и может являться важным фактором в эпидемиологии и распространении бактерии [29]. Кокковидная форма бактерии не поддаётся культивированию на искусственных питательных средах (хотя может спонтанно возникать по мере «старения» культур), но была обнаружена в водных источниках в США и других странах. Кокковидная форма бактерии также обладает способностью к адгезии к клеткам эпителия желудка in vitro. Кокковидные формы H. pylori могут обнаруживаться после попыток уничтожения, и имеются данные о том, что они более устойчивы к антибиотикам и синтезируют больше веществ, способствующих вирулентности и канцерогенезу, чем спиралевидные [30] .
Кокковидные клетки отличаются деталями строения клеточной стенки (преобладанием N-ацетил-D-глюкозаминил-β(1, 4)-N-ацетилмурамил-L-Ала — D-Глю мотива в пептидогликане клеточной стенки (GM-дипептида )), изменение строения клеточной стенки приводит к неузнаванию бактерии иммунной системой хозяина (бактериальная мимикрия ) [31] .
Геном [ править | править код ]
Электронно-микроскопическая фотография H. pylori
Геном штамма «26695» представлен кольцевой двуцепочечной молекулой ДНК размером 1667867 пар оснований. и содержит 1630 генов, из которых 1576 кодируют белки. доля Г+Ц пар составляет 38%. Геном штамма «J99» представлен кольцевой двуцепочечной молекулой ДНК размером 1643831 пар оснований. и содержит 1535 генов, из которых 1489 кодируют белки. доля Г+Ц пар составляет 39%. Два изученных штамма демонстрируют значительные генетические различия, до 6% нуклеотидов у них различны.
Изучение генома H. pylori ведётся в основном с целью улучшить наше понимание патогенеза гастритов и язвенной болезни желудка, причин способности этого микроорганизма вызывать заболевание. На данный момент в базе данных генома Helicobacter pylori 62 гена отнесены к категории «генов патогенных» (то есть их наличие у бактерии коррелирует с её патогенностью). Оба изученных штамма имеют общий «остров патогенности» (общую последовательность генов, имеющих отношение к вирулентности и патогенности H. pylori ) длиной около 40 Кб, так называемый Cag. Этот участок содержит более 40 генов. Он обычно отсутствует у штаммов, которые выделены от людей, являющихся бессимптомными носителями H. pylori .
Ген cagA кодирует один из важнейших белков вирулентности H. pylori. Штаммы, имеющие ген cagA ассоциированны со способностью вызывать тяжёлые формы язвы желудка. Ген cagA кодирует белок длиной 1186 аминокислотных остатка. Белок cagA транспортируется внутрь клеток, где он нарушает нормальное функционирование цитоскелета. Остров патогенности Cag состоит из примерно 30 генов, кодирующих сложную систему секреции типа IV [36]. После адгезии H. pylori к клеткам эпителия желудка, cagA впрыскивается в клетку посредством системы секреции типа IV. Белок cagA фосфолирируется тирозиновыми протеинкиназами клетки и взаимодействует с фосфатазой Src. изменяя морфологию клеток [37]. Вирулентные штаммы H. pylori способны активировать рецептор эпидермального фактора роста (epidermal growth factor receptor, EGFR), мембранный белок с тирозинкиназным доменом. Активация EGFR H. pylori ассоциирована с изменённой сигнальной трансдукцией и изменением профиля экспрессии генов клетки хозяина, что может влиять на течение патологического процесса [38] .
Показана синергетичность действия генов babA2, cagA. и s1 vacA при патологическом процессе, вовлечённом в метаплазии кишечника [39]. Продукты генов cagA и babA2 идентифицируются иммуногистохимически. гистологически и при помощи in situ гибридизации при метаплазии кишечника и злокачественных новообразованиях желудка, ассоциированных с геликобактерной инфекцией и могут служить возможными диагностическими маркерами [40] .
Также идентифицированы некоторые гены, ассоциированные со способностью к колонизации эпителия желудка, такие как flg. flh. tlp (отвечают за наличие жгутиков и хемотаксис ), ureA, nixA, amiE (гены, отвечающие за синтез уреазы и продукцию аммиака), fur, pfr, fecA, frpB (гены, отвечающие за метаболизм железа ), sod, hptG (ответ на стресс), и algA, rfaJ, lpxB (гены, отвечающие за биосинтез липополисахарида и экзополисахарида ) [41]. Показана роль в реакциях Helicobacter pylori на внешние раздражители продукта гена tlpD. предположительно кодирующего сенсорный белок [42] .
Факторы вирулентности [ править | править код ]
Факторы вирулентности H. pylori
Способность H. pylori колонизировать слизистую желудка и вызывать гастрит либо язву желудка зависит не только от состояния иммунитета организма хозяина, но и от индивидуальных особенностей конкретного штамма бактерии [43] .
Одним из важных факторов вирулентности геликобактера является наличие у него жгутиков, благодаря которым обеспечивается быстрое движение микроорганизма в слое густой слизи, защищающей слизистую желудка от воздействия кислоты. её хемотаксис в места скопления других бактерий этого вида и быстрая колонизация слизистой.
Липополисахариды и белки наружной оболочки бактерии обладают свойством адгезии к наружной оболочке мембран клеток слизистой желудка. Кроме того, липополисахариды наружной оболочки H. pylori вызывают иммунный ответ организма хозяина и развитие воспаления слизистой.
Секретируемые бактерией во внешнюю среду литические ферменты — муциназа. протеаза. липаза — вызывают деполимеризацию и растворение защитной слизи (состоящей в основном из муцина ) и повреждение слизистой желудка.
Молекулярная модель уреазы H. pylori
Очень важную роль в вирулентности бактерии и в её способности выживать в кислом содержимом желудка играет секреция бактерией уреазы — фермента. расщепляющего мочевину с образованием аммиака. Аммиак нейтрализует соляную кислоту желудка и обеспечивает бактерии локальное поддержание комфортного для неё pH (около 6–7). Одновременно с этим аммиак вызывает химическое раздражение и воспаление. а впоследствии и гибель, клеток слизистой желудка.
Продукция геликобактером различных экзотоксинов, в частности, вакуолизирующего экзотоксина (продукта гена vacA), также вызывает вакуолизацию, повреждение и гибель клеток слизистой желудка.
Специальная «инжекционная система», имеющаяся у H. pylori. предназначена для непосредственного впрыскивания в клетки слизистой оболочки желудка различных эффекторных белков (в частности, продуктов гена cagA), вызывающих воспаление. повышение продукции интерлейкина-8 [44]. угнетение апоптоза и избыточный рост определённых типов клеток. Полагают, что именно этим обусловлена наблюдающаяся при инфицировании геликобактером гиперплазия париетальных (кислотообразующих) клеток желудка. гиперсекреция соляной кислоты и пепсина. и в конечном итоге повышение вероятности рака желудка [45] .
Штаммы H. pylori. выделенные от больных с язвой желудка или двенадцатиперстной кишки, как правило, проявляют большую биохимическую агрессивность, чем штаммы, выделенные от больных с гастритом, а штаммы, выделенные от больных с гастритом, обычно более агрессивны и вирулентны, чем штаммы, выделенные от бессимптомных носителей [43]. В частности, штаммы, выделенные от больных с язвенной болезнью, чаще бывают cagA-положительными (то есть продуцирующими cagA эффекторные белки). Штаммы, выделенные от больных с гастритом, чаще продуцируют экзотоксин vacA, чем штаммы, выделенные от бессимптомных носителей [46] [47] .
Патогенетические механизмы [ править | править код ]
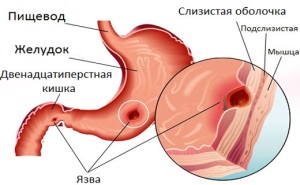
Схематическое изображение патогенеза язвы желудка
На начальном этапе после попадания в желудок H. pylori. быстро двигаясь при помощи жгутиков, преодолевает защитный слой слизи и колонизирует слизистую оболочку желудка. Закрепившись на поверхности слизистой, бактерия начинает вырабатывать уреазу, благодаря чему в слизистой оболочке и слое защитной слизи поблизости от растущей колонии растёт концентрация аммиака и повышается pH. По механизму отрицательной обратной связи это вызывает повышение секреции гастрина клетками слизистой желудка и компенсаторное повышение секреции соляной кислоты и пепсина. с одновременным снижением секреции бикарбонатов.
Муциназа. протеаза и липаза. вырабатываемые бактерией, вызывают деполимеризацию и растворение защитной слизи желудка, в результате чего соляная кислота и пепсин получают непосредственный доступ к оголённой слизистой желудка и начинают её разъедать, вызывая химический ожог, воспаление и изъязвление слизистой оболочки.
Эндотоксин VacA, вырабатываемый бактерией, вызывают вакуолизацию и гибель клеток эпителия желудка [48]. Продукты гена cagA вызывают дегенерацию клеток эпителия желудка, вызывая изменения фенотипа клеток (клетки становятся удлинёнными, приобретая так называемый «колибри фенотип» [49] ). Привлечённые воспалением (в частности, секрецией интерлейкина-8 клетками слизистой желудка) лейкоциты вырабатывают различные медиаторы воспаления, что приводит к прогрессированию воспаления и изъязвления слизистой, бактерия также вызывает окислительный стресс и запускает механизм программируемой клеточной смерти клеток эпителия желудка [50] .